Modo de expresar las concentraciones
Ya sabemos que la concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. También debemos aclarar que los términos diluida o concentrada expresan concentraciones relativas.
Las unidades de concentración en que se expresa una solución o disolución pueden clasificarse en unidades físicas y en unidades químicas.
Unidades físicas de concentración
Las unidades físicas de concentración están expresadas en función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.

b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
Ejercicio:
Se tiene un litro de solución al 37%. ¿Cuántos litros de agua se tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las unidades físicas de concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V = volumen, C= concentración
V1 = 1 litro
C1 = 37%
37% P/V = significa que hay 37 gramos de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
Regla para calcular disoluciones o concentraciones
V1 • C1 = V2 • C2
Puede expresarse en: % P/V
Reemplazando los datos que se tienen del problema, se obtiene:
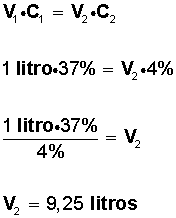
Entonces, si tenemos un litro de solución al 37%; para obtener una solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuantos litros de agua hay que agregar al litro inicial, hacemos:
V2 – V1 = Volumen de agua agregado
9,25 – 1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de agua
Unidades químicas de concentración
Para expresar la concentración de las soluciones se usan también sistemas con unidades químicas, como son:
a) Fracción molar
b) Molaridad M = (número de moles de soluto) / (1 litro de solución)
c) Molalidad m = (número de moles de soluto) / (1 kilo de solvente)
a) Fracción molar (Xi): se define como la relación entre los moles de un componente (ya sea solvente o soluto) de la solución y los moles totales presentes en la solución.
Ejercicio:
Se agregan 3 gramos de sal en una cacerola con 4 litros de agua ¿cuál es la concentración de sal?, o dicho de otra forma ¿cuál es la concentración de la solución?
Calcular la fracción molar de solvente y de soluto: Recordemos que la fracción molar expresa la concentración de una solución en Moles de Soluto o de Solvente por Moles Totales de la Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4 litros) de solvente.
Con estos datos debemos resolver el problema, calculando 4 valores significativos: moles de solvente, moles de soluto, fracción molar de solvente y fracción molar de soluto.
Para el agua, se conoce su masa molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de O).
Averiguar cuántos moles de solvente H2O) tenemos:
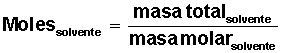
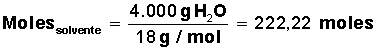
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
Averiguar cuántos moles de soluto tenemos:
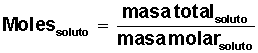
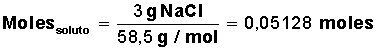
Ahora que conocemos la cantidad de moles de solvente y la cantidad de moles de soluto, podemos calcular las fracciones molares de solvente y de soluto:
Fracción molar del solvente = Xsolvente
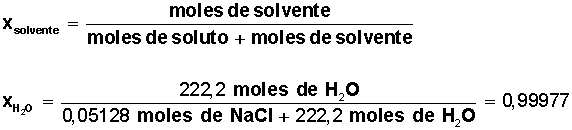
Fracción molar del solvente (agua) = 0,99977
Fracción molar del soluto= Xsoluto

Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
La Fracción Molar no se expresa con unidades
b) Molaridad (M): Es el número de moles de soluto contenido en un litro de solución. Una solución 4 molar (4 M) es aquella que contiene cuatro moles de soluto por litro de solución.
Ejercicio:
¿Cuál será la molaridad de una solución que contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en 500 ml de solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5 litro)
Primero calculamos la cantidad de moles que hay en 64 g de metanol.
Si un mol de metanol equivale a 32 g, 64 g equivalen a 2 moles (64/32=2)
Aplicamos la fórmula:
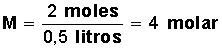
Respuesta: 4 molar
c) Molalidad (m)
En primer lugar debemos advertir que molalidad no es lo mismo que molaridad por lo cual debemos evitar confundirlas puesto que el nombre es muy parecido pero en realidad cambian mucho los cálculos, y es un grave error pero muy frecuente.
En la molalidad relacionamos la molaridad del soluto con el que estamos trabajando con la masa del disolvente (en kg) que utilizamos.
La definición de molalidad es la siguiente:
Relación entre el número de moles de soluto por kilogramos de disolvente Molalidad (m)


Gracias, claro, entendible. Genial.
ResponderEliminarcuanto gramos de Mn02 07 hay en 2 moles de este compuesto
ResponderEliminarcuanto gramos de Mn02 07 hay en 2 moles de este compuesto
ResponderEliminar0.01
Eliminar0.01
EliminarMuchas Gracias
ResponderEliminaramigo me podrias resolver este ejercicio esque no lo entiendo bien es urgente porfa :determina la cantidad de moles entre kilogramos de solvente de una solucion que contiene 348gramos de oxido bismutico disuelto en 880 miligramos de soluccion
ResponderEliminar